最近,上海君实生物科技有限公司(Junshi Biosciences)宣布其PD-1 /TGF-β双功能融合蛋白JS201注射液(JS201)的临床试验申请已被中国国家药品管理局(NMPA)接受。
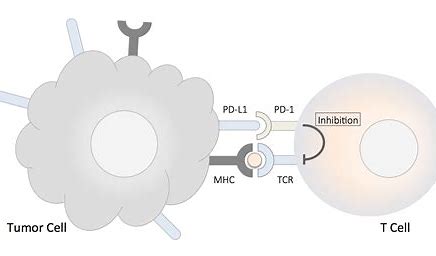
JS201是君实生物使用其专有技术开发的一种双功能融合蛋白,可以同时靶向PD-1和TGF-β(转化生长因子-β)。JS201是首个获准在中国进行临床试验的靶向PD-1/TGF-β的产品。JS201可有效阻断PD-1和TGF-β的免疫抑制途径,提高肿瘤微环境中的免疫调节作用,从而增强患者免疫系统对肿瘤细胞的杀伤作用、减少免疫逃逸和耐药性的发生。
Junshi Biosciences是中国第一家获得抗PD-1单克隆抗体销售许可的中国制药公司。其针对实体瘤的人类首创抗BTLA抗体是世界上第一个被FDA和NMPA批准用于临床试验的抗体。其抗PCSK9单克隆抗体是NMPA在中国批准的第一项临床试验。2020年初,Junshi Biosciences与中国科学院微生物研究所和礼来公司共同开发了JS016,这是中国首个针对SARS-CoV-2的完全人源单克隆抗体,现已进入临床试验。
目前,Junshi Biosciences在美国(旧金山和马里兰州)和中国(上海、苏州、北京和广州)拥有2,000多名员工。
原始出处:
https://www.firstwordpharma.com/node/1807148?tsid=4